Dolore, stipsi e nutraceutica nell’anziano
Update sul trattamento del dolore - Il trattamento della stipsi da oppioidi - Nutraceutica e anziano
Antonio Cherubini, Alice Laudisio, Anna Picca
Anno: 2022
Caratteristiche:
Un approfondimento dal Congresso Nazionale SIGG 2021 sui temi del dolore, della stipsi nella popolazione anziana e sull’uso dei nutraceutici che tengano contro della complessità dei fenomeni legati all’invecchiamento.
FREE DOWNLOADS
Descrizione
Update sul trattamento del dolore
Antonio Cherubini
UOC Geriatria, Accettazione geriatrica e Centro di ricerca per l’invecchiamento, IRCCS INRCA, Ancona
La nuova definizione del dolore, coniata dall’International Association for the Study of Pain, è: “Un’esperienza sensoriale ed emotiva spiacevole causata, o simile a quella causata, da un danno tissutale in atto o potenziale” 1. Rispetto a quella precedente, nella nuova definizione è stato eliminato il riferimento all’espressione verbale del dolore, perché si è ritenuto che essa discriminasse chi non può esprimersi, come il neonato e l’anziano con deterioramento cognitivo. In effetti, la descrizione verbale è solo uno dei tanti comportamenti per esprimere il dolore; l’incapacità di comunicare non nega la possibilità che un essere umano o un animale provi dolore. La nuova definizione sottolinea che il dolore è sempre un’esperienza personale, che è influenzata in varia misura da fattori biologici, psicologici e sociali 1. In questo senso, dolore e nocicezione sono fenomeni diversi: il dolore non può essere dedotto esclusivamente dall’attività dei neuroni sensoriali. Attraverso le loro esperienze di vita, gli individui apprendono il concetto di dolore. Quando una persona riferisce una determinata esperienza come dolorosa, sia verbalmente che attraverso una comunicazione non verbale, tale dichiarazione va rispettata. Sebbene il dolore di solito svolga un ruolo adattativo, può avere effetti negativi sulla funzione e sul benessere sociale e psicologico dell’individuo.
Esistono vari tipi di dolore 2: oltre al dolore nocicettivo (quello che deriva da un danno al tessuto non neurale o da una minaccia di danno, causato dall’attivazione dei nocicettori) e al dolore neuropatico (quello causato da una lesione o malattia del sistema nervoso somatosensoriale), recentemente è stata introdotta la categoria del dolore nociplastico (il dolore che deriva da nocicezione alterata, nonostante nessuna chiara evidenza di danno tissutale reale o minacciato, che causa l’attivazione di nocicettori periferici o evidenza di malattia o lesione del sistema somatosensoriale che causa il dolore).
Il dolore cronico è molto frequente nella popolazione anziana. Per quanto riguarda la sua epidemiologia, si verifica nel 25-76% delle persone che vivono in comunità e nell’83-93% delle persone che vivono nelle residenze per anziani 3. Nel rapporto OsMed 2021 sull’uso dei farmaci nel 2019 4, i farmaci per la terapia del dolore (oppiacei, loro associazioni, gabapentin e pregabalin) vengono utilizzati in maniera crescente con l’avanzare dell’età e in misura maggiore nel genere femminile: dal 7,6 e 10,5% rispettivamente degli uomini e delle donne di 65-69 anni si arriva fino al 18,3% e al 23,2% degli uomini e delle donne con età di 85 anni o più (Tab. I). Il consumo di FANS è ancora maggiore, con percentuali medie del 28,6% negli uomini con età ≥ 65 anni e del 35,1% delle donne di ≥ 65 anni (Tab. I). In questo rapporto mancano i dati sui farmaci OTC, tra cui gli analgesici sono i più utilizzati.
La presenza di dolore nella popolazione anziana va indagata costantemente, perché gli anziani tendono a essere reticenti nel riferire la sensazione dolorosa, sia perché ritengono che il dolore sia normale con l’invecchiamento, sia per abitudine a sopportarlo, sia per paura dei farmaci o di essere di peso per gli altri 5,6.
La valutazione del dolore cronico è molto importante, perché esso ha un impatto estremamente significativo sulle condizioni generali di salute dell’anziano, in quanto la sua presenza è associata a una serie di outcome negativi, come ridotta funzionalità fisica, cadute, diminuzione dell’appetito, riduzione della mobilità, disturbi del sonno, depressione e ansia, fino al delirium e al deterioramento cognitivo.
Per questo motivo non sorprende che vi siano numerosi studi che collegano il dolore cronico con la fragilità. In una recente revisione e meta-analisi sull’associazione tra fragilità e dolore cronico nell’anziano 7, sono stati inclusi 24 studi (12 trasversali e 12 longitudinali): negli studi trasversali la prevalenza di fragilità nelle persone con dolore cronico era del 18% e del 43% per la prefragilità, mentre la prevalenza del dolore cronico era del 50% per gli individui con fragilità e del 37% per gli individui con prefragilità. Negli studi longitudinali le persone con dolore cronico avevano una probabilità 1,85 volte superiore di sviluppare fragilità rispetto al resto della popolazione a un follow-up medio di 5,8 anni (Fig. 1).

In questo senso il dolore cronico è stato paragonato a una sindrome geriatrica: ad esempio, per la lombalgia cronica, vi sono cause locali (osteoarticolari e muscolari) che causano il dolore, ma vi possono essere anche cause generali (demenza, depressione, ansia, coping disadattativo, insonnia) che possono aggravare il dolore e contribuire alla disabilità del soggetto anziano 8.
Per quanto riguarda l’approccio al dolore, tutti i pazienti hanno il diritto di ricevere un trattamento appropriato per il dolore. In effetti, con la legge n. 38 del 2010, l’Italia è stato il primo paese europeo a dotarsi di una legge sul dolore: ponendosi a tutela della dignità della persona, la legge sancisce il diritto di accesso alle cure palliative e alla terapia del dolore di ciascun individuo.
Di fronte al paziente, bisogna capire quanto il dolore incide sulle attività e la qualità della vita del soggetto, per cercare di ridurre questo impatto come obiettivo realistico della terapia; poi è necessario indagare la causa del dolore e le condizioni che vi contribuiscono, oltre a conoscere la situazione complessiva del paziente, perché essa incide sulla prescrizione del trattamento.
In generale, il trattamento del dolore deve essere basato su una attenta valutazione dei rischi e dei benefici delle differenti opzioni terapeutiche. Negli anziani di solito è consigliato un approccio “a gradini”: inizialmente vanno utilizzati gli interventi meno potenzialmente rischiosi seguiti, se necessario, da terapie associate a rischi maggiori. Di conseguenza, l’uso di trattamenti non farmacologici o l’uso localizzato di farmaci (ad es., iniezioni di corticosteroidi, applicazioni topiche) viene preferito come terapia iniziale per molte condizioni, in particolare nei pazienti con multimorbidità e polifarmacoterapia. I farmaci sistemici vengono generalmente introdotti in una fase successiva rispetto a quanto avviene nei giovani adulti, a causa dell’aumento del potenziale di effetti collaterali, tossicità e interazioni con i farmaci usati per le malattie croniche nell’anziano.
Gli interventi non farmacologici per il dolore cronico comprendono gli interventi fisici (fisioterapia, agopuntura, TENS, manipolazione chiropratica, massaggi e altro) e gli interventi psicoeducativi (terapia cognitivo-comportamentale, meditazione, formazione del paziente). Complessivamente, gli interventi non farmacologici sono associati a minimi effetti collaterali, ma hanno evidenze limitate nell’anziano, anche se l’efficacia non sembra diversa da quella ottenuta nell’adulto giovane. Recentemente è stata pubblicata una revisione sistematica e meta-analisi degli studi sull’associazione tra interventi psicologici e outcome del dolore cronico negli anziani 9: su 2608 partecipanti, gli interventi psicologici che hanno utilizzato una modalità di terapia cognitivo-comportamentale sono stati associati a benefici statisticamente significativi in termini di riduzione del dolore e credenze catastrofiche, oltre a un miglioramento della gestione del dolore stesso. I benefici erano piccoli e documentati al momento del completamento del trattamento; l’unico effetto che persisteva dopo il termine del trattamento a distanza anche di 6 mesi era proprio la riduzione del dolore (Fig. 2).

Anche l’esercizio fisico (in particolare quello volto a rafforzamento muscolare, resistenza e flessibilità), sia pure con evidenze meno conclusive, può essere di aiuto nel trattamento del dolore negli anziani, come affermato nelle recenti linee guida sul trattamento del dolore cronico negli anziani pubblicate dalla British Pain Society 10.
Per quanto riguarda il trattamento farmacologico, la gestione della terapia farmacologica dell’anziano è un compito fondamentale del geriatra, che rispetto ad altri specialisti è maggiormente in grado di valutare la terapia nel suo complesso 11. Gli obiettivi del trattamento dovrebbero essere stabiliti reciprocamente per gestire il dolore a un livello che permetta al paziente di svolgere le attività e raggiungere una qualità di vita accettabile, preferendo la formulazione e la modalità di somministrazione più idonea per il paziente.
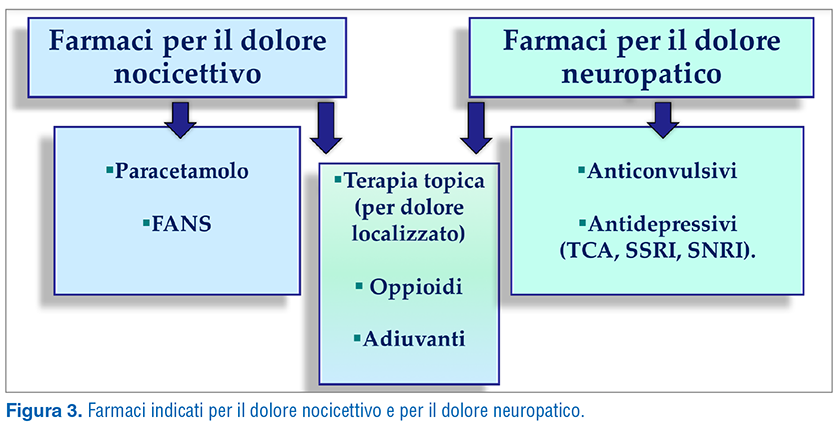
Vi sono molti farmaci a disposizione, alcuni agiscono prevalentemente sul dolore nocicettivo (paracetamolo e FANS), altri sul dolore neuropatico (anticonvulsivi e antidepressivi come triciclici, SSRI e SNRI), altri ancora sono efficaci in ambedue i tipi di dolore (terapia topica per il dolore localizzato, oppioidi, adiuvanti) (Fig. 3). Nella scelta del farmaco è fondamentale conoscere le caratteristiche del paziente, così come quelle dei farmaci che si possono utilizzare (indicazioni, effetti collaterali attesi): questo consente una prescrizione più appropriata, minimizzando i rischi, e una maggiore aderenza terapeutica da parte del paziente.
In effetti, vi sono diversi ordini di fattori che influenzano il trattamento farmacologico del dolore negli anziani: 1) le comorbidità, tra cui alcune condizioni come scompenso cardiaco o insufficienza renale, stipsi, obesità, disturbi del sonno, difficoltà nel camminare e propensione alle cadute, perdita di memoria, che possono sconsigliare l’uso di alcuni farmaci; 2) i fattori psicologici, come depressione/ansia, capacità di coping e paura del movimento, che possono richiedere trattamenti specifici, oltre all’aspettativa di trattamento, che influenza la risposta alla terapia; 3) i fattori sociali, come l’isolamento sociale e la condizione economica, che possono interferire con l’aderenza al trattamento.
Il paracetamolo è un farmaco spesso efficace 12,13, la cui dose iniziale raccomandata è di 325-500 mg ogni 4 ore, oppure 500-1000 mg ogni 6-8 ore, fino a un massimo di 3 g al giorno, che vanno ridotti a un massimo di 2 g al giorno per gli anziani fragili, di età ≥ 80 anni, a rischio di epatotossicità (ad es., consumo regolare di alcol o malnutrizione). Va tenuto presente che il paracetamolo non ha una significativa azione anti-infiammatoria (quindi è poco efficace nelle patologie di tipo infiammatorio) e interagisce con il warfarin prolungando l’INR.
I FANS si utilizzano negli anziani come seconda scelta 12,13: in particolare, anche se i diversi farmaci hanno profili leggermente diversi, va posta attenzione nei pazienti con insufficienza renale cronica, problemi gastrici, ipertensione, malattia cardiovascolare o scompenso cardiaco. Sono infatti più efficaci rispetto al paracetamolo per il dolore infiammatorio, ma a causa dell’elevato rischio di effetti collaterali negli anziani, il loro uso deve essere limitato a brevi cicli di trattamento.
Tra gli oppioidi 12,13, si distingue tra quelli deboli (tramadolo, codeina) e quelli forti (morfina, idromorfone, ossicodone, fentanil e buprenorfina). La dose iniziale dovrebbe essere minore nell’anziano, con una riduzione di circa il 25% dopo i 60 anni e del 50% dopo gli 80 anni. Se è presente insufficienza renale, la dose va opportunamente aggiustata o vanno utilizzati i preparati non eliminati per via renale (fentanil e buprenorfina). Negli ultimi 15-20 anni vi è stato un progressivo incremento dell’uso di oppioidi negli Stati Uniti, tanto che si è parlato di “opioid crisis” 14 (Fig. 4).

Questo ha determinato un ripensamento sull’uso di questa categoria di farmaci: in effetti, gli analgesici contenenti oppioidi sono i farmaci maggiormente implicati negli accessi in pronto soccorso degli anziani 15. A differenza degli Stati Uniti, anche se in alcuni paesi dell’Europa occidentale vi è stato un progressivo incremento delle prescrizioni di oppioidi e dei rischi conseguenti ai danni correlati al loro uso, l’Europa nel suo insieme non sta affrontando una crisi degli oppiacei e si ritiene che le discussioni sui potenziali danni degli oppioidi non dovrebbero ostacolare la loro prescrizione 16. In particolare, gli oppioidi sono efficaci nel trattamento del dolore persistente associato a condizioni muscoloscheletriche e nella gestione di diverse condizioni di dolore neuropatico. Va tenuto presente che gli anziani sono più suscettibili agli effetti avversi indotti dagli oppioidi, tra cui depressione respiratoria, ipotensione, delirium, stipsi, sedazione eccessiva e accumulo di farmaci. Per questo motivo è consigliabile utilizzare inizialmente basse dosi di oppioidi, magari associandoli ad altre categorie di farmaci e titolando gradualmente la dose, per ridurre il rischio di accumulo e sovradosaggio. Recentemente sono state pubblicate le raccomandazioni europee sull’uso degli oppioidi nel trattamento del dolore non oncologico 17.
Tra i farmaci adiuvanti utilizzati nel trattamento del dolore cronico vi sono gli anticonvulsivi (carbamazepina, lamotrigina, gabapentin, pregabalin), i corticosteroidi, gli antidepressivi triciclici, i farmaci dal doppio meccanismo (tapentadolo e tramadolo), i cannabinoidi, le benzodiazepine. Anche questi farmaci vanno conosciuti bene, per i loro possibili effetti terapeutici, ma anche i loro effetti collaterali: ad esempio, in un recente articolo 18 è stata sottolineata la cosiddetta “cascata prescrittiva” di gabapentinoidi in anziani con lombalgia cronica. Tali farmaci possono infatti determinare la comparsa di edemi che vengono trattati con la prescrizione di diuretici, non essendo compreso che si tratta di un effetto collaterale.
In conclusione, il dolore nel paziente anziano è una condizione importante, che deve essere diagnosticata e trattata. Nel trattamento del dolore cronico è necessario applicare tutti i principi della farmacoterapia geriatrica. Il trattamento multimodale, non farmacologico e farmacologico, è quello raccomandato nell’anziano, perché consente di ottenere i risultati migliori riducendo i rischi di effetti collaterali.
Bibliografia
1 Raja SN, Carr DB, Cohen M, et al. The revised International Association for the Study of Pain definition of pain: concepts, challenges, and compromises. Pain 2020;161:1976-1982. https://doi.org/10.1097/j.pain.0000000000001939
2 IASP Terminology. International Association for the Study of Pain (https://iaspfiles.s3.amazonaws.com/production/public/2021/Part_III-PainTerms.pdf).
3 Abdulla A, Adams N, Bone M, et al.; British Geriatric Society. Guidance on the management of pain in older people. Age Ageing 2013;42(Suppl 1):i1-57. https://doi.org/10.1093/ageing/afs200
4 Osservatorio Nazionale sull’Impiego dei Medicinali – AIFA. L’uso dei farmaci in Italia. Rapporto nazionale anno 2019 (https://www.aifa.gov.it/documents/20142/1205984/rapporto-osmed-2019.pdf/f41e53a4-710a-7f75-4257-404647d0fe1e).
5 Weiner DK, Sakamoto S, Perera S, et al. Chronic low back pain in older adults: prevalence, reliability, and validity of physical examination findings. J Am Geriatr Soc 2006;54:11-20. https://doi.org/10.1111/j.1532-5415.2005.00534.x
6 Culberson JW, Ziska M. Prescription drug misuse/abuse in the elderly. Geriatrics 2008;63:22-31.
7 Lin T, Zhao Y, Xia X, et al. Association between frailty and chronic pain among older adults: a systematic review and meta-analysis. Eur Geriatr Med 2020;11:945-959. https://doi.org/10.1007/s41999-020-00382-3
8 Weiner DK, Marcum Z, Rodriguez E. Deconstructing chronic low back pain in older adults: summary recommendations. Pain Med 2016;17:2238-2246. https://doi.org/10.1093/pm/pnw267
9 Niknejad B, Bolier R, Henderson CR Jr, et al. Association between psychological interventions and chronic pain outcomes in older adults: a systematic review and meta-analysis. JAMA Intern Med 2018;178:830-839. https://doi.org/10.1001/jamainternmed.2018.0756
10 Schofield P, Dunham M, Martin D, et al. Evidence-based clinical practice guidelines on the management of pain in older people – a summary report. Brit J Pain 2020:1-8. https://doi.org/10.1177/2049463720976155
11 Cherubini A, Laroche ML, Petrovic M. Mastering the complexity: drug therapy optimization in geriatric patients. Eur Geriatr Med 2021;12:431-434. https://doi.org/10.1007/s41999-021-00493-5
12 American Geriatrics Society Panel on Pharmacological Management of Persistent Pain in Older Persons. Pharmacological management of persistent pain in older persons. J Am Geriatr Soc 2009;57:1331-1346. https://doi.org/10.1111/j.1532-5415.2009.02376.x
13 Galicia-Castillo MC, Weiner DK. Treatment of chronic non-cancer pain in older adults. In: Schmader KE, Fishman S, Eds. UptoDate 2021.
14 Steinman MA, Komaiko KD, Fung KZ, et al. Use of opioids and other analgesics by older adults in the United States, 1999-2010. Pain Med 2015;16:319-327. https://doi.org/10.1111/pme.12613
15 Gurwitz JH. Preventing opioid-related adverse drug events: we can do this! J Am Geriatr Soc 2021;Oct 27. https://doi.org/10.1111/jgs.17526 [Epub Ahead of Print]
16 Häuser W, Buchser E, Finn DP, et al. Is Europe also facing an opioid crisis? A survey of European Pain Federation chapters. Eur J Pain 2021;25:1760-1769. https://doi.org/10.1002/ejp.1786
17 Häuser W, Morlion B, Vowles KE, et al. European* clinical practice recommendations on opioids for chronic noncancer pain – Part 1: role of opioids in the management of chronic noncancer pain. Eur J Pain 2021;25:949-968. https://doi.org/10.1002/ejp.1736
18 Read SH, Giannakeas V, Pop P, et al. Evidence of a gabapentinoid and diuretic prescribing cascade among older adults with lower back pain. J Am Geriatr Soc 2021;69:2842-2850. https://doi.org/10.1111/jgs.17312
Il trattamento della stipsi da oppioidi
Alice Laudisio
Area di Geriatria, Università Campus Bio-Medico di Roma, Roma
La stipsi da oppioidi (opioid-induced constipation, OIC) viene definita come la comparsa o il peggioramento dei sintomi da costipazione, associati all’inizio della terapia con oppioidi o conseguenti alle modifiche della terapia con oppioidi 1.
La OIC ha un’altissima prevalenza 2-4: si verifica nel 60-90% dei pazienti che assumono oppioidi per dolore cronico neoplastico e in circa il 40-60% dei pazienti che assumono oppioidi per dolore cronico di natura non neoplastica. La rilevanza dell’argomento è dovuta anche al fatto che i sintomi della OIC possono condurre i pazienti a una mancata aderenza al trattamento con oppioidi, con peggioramento del dolore e della qualità di vita 5. La OIC è stata correlata anche a un peggiore stato di performance misurato con i criteri dell’Eastern Cooperative Oncology Group (ECOG) 6.
Non tutti gli oppioidi determinano OIC con uguale frequenza, anche se non ci sono evidenze definitive. Ad esempio, c’è meno costipazione con il fentanil transdermico rispetto alla morfina orale a rilascio prolungato 7,8.
L’evidenza suggerisce che il rischio di OIC aumenta con l’età 9,10. Inoltre, la OIC è sottostimata e sottotrattata nella popolazione anziana, che spesso non risponde ai lassativi convenzionali. Gli studi sui residenti nelle case di cura mostrano che la OIC è associata a peggiori esiti fisici e mentali nei pazienti più anziani 11.
I criteri diagnostici della OIC si basano sulla presenza di nuovi sintomi o sul peggioramento della stipsi quando si inizia, si modifica o si aumenta la terapia oppioide e deve comprendere 2 o più segni (criteri di Roma IV) 12 (Tab. I). Questi criteri rappresentano la base della prescrivibilità e della rimborsabilità dei farmaci per il trattamento della OIC.
La terapia della OIC si basa su una nuova classe di farmaci, gli antagonisti dei recettori μ-oppioidi ad azione periferica (Peripherally acting μ-opioid receptor antagonists, PAMORA), che mirano a contrastare la OIC senza influenzare l’analgesia mediata dagli oppioidi 13,14. I PAMORA non attraversano o attraversano in misura molto scarsa la barriera emato-encefalica ed esercitano i loro benefici terapeutici riducendo al minimo le azioni degli oppioidi esogeni sui recettori μ-oppioidi periferici, compreso il tratto gastrointestinale. Questa classe di farmaci comprende 3 molecole: naloxone, naldemedina e naloxegol 15. Queste molecole hanno un profilo farmacocinetico e farmacodinamico diverso. La molecola con le caratteristiche migliori in termini di stabilità e di durata d’azione è la naldemedina 15: essa infatti mostra un antagonismo non competitivo e una cinetica di associazione e dissociazione più lenta dai recettori μ-oppioidi rispetto a naloxone e naloxegol; inoltre presenta un antagonismo insormontabile dell’inibizione indotta dalla morfina e sintomi di astinenza periferici più bassi e più lenti (diarrea) rispetto agli altri composti. Come si può vedere in Tabella II, la naldemedina ha una buona biodisponibilità, non mostra nessuna interferenza da cibo, presenta una lunga emivita, un’escrezione prevalentemente renale, nessun effetto di sesso, età, razza e BMI, nessun effetto dell’insufficienza renale ed epatica (fino a Child-Pugh 7-9) sulla dose raccomandata, nessun effetto su citocromi epatici o glicoproteina P 16.
L’efficacia di naldemedina nella OIC è stata dimostrata dagli studi COMPOSE-1 e COMPOSE-2, che sono due trial multicentrici di fase 3 randomizzati in doppio cieco, condotti in pazienti con dolore non neoplastico in trattamento con oppioidi 17. I pazienti eleggibili erano di età compresa tra 18 e 80 anni, non usavano lassativi e avevano un regime oppioide stabile per il trattamento di dolore cronico non oncologico, con una dose giornaliera totale media di almeno 30 mg (equivalente di morfina) da almeno 1 mese prima dello screening. I pazienti venivano randomizzati 1:1 a naldemedina 200 mcg al giorno o placebo. L’endpoint primario era la percentuale di responder: era considerato responder chi aveva avuto almeno tre movimenti intestinali spontanei (SBM) a settimana, con un aumento rispetto al basale di almeno un SBM a settimana, per almeno 9 settimane del periodo di trattamento di 12 settimane, incluse almeno 3 delle ultime 4 settimane. Rispetto al placebo, naldemedina ha mostrato un numero di responder significativamente maggiore nella popolazione intention-to-treat in ambedue gli studi 17 (Fig. 1).

Anche gli endpoint secondari di (A) variazione della frequenza degli SBM a settimana dal basale alle ultime 2 settimane del periodo di trattamento; (B) variazione della frequenza degli SBM a settimana dal basale alla prima settimana del periodo di trattamento; (C) variazione della frequenza delle SBM a settimana dal basale alle ultime 2 settimane del periodo di trattamento; (D) variazione della frequenza degli SBM senza sforzo a settimana dal basale alle ultime 2 settimane del periodo di trattamento erano significativamente a favore del trattamento con naldemedina 17 (Fig. 2). Nei due studi naldemedina è risultata generalmente ben tollerata, con pochi effetti collaterali prevalentemente a livello gastrointestinale, tra cui il più frequente era la diarrea; tali eventi erano attesi, visto il suo meccanismo d’azione, che neutralizza l’effetto degli oppioidi sui recettori μ-oppioidi nel tratto gastrointestinale 17.

Un ulteriore studio (COMPOSE-3), anch’esso multicentrico di fase 3 randomizzato in doppio cieco, ha valutato la sicurezza e la tollerabilità a lungo termine della naldemedina orale alla dose di 200 mcg per 52 settimane in pazienti con dolore cronico non oncologico, in terapia stabile con oppioidi; i pazienti dello studio potevano anche assumere altri lassativi 18. In questo studio il trattamento a lungo termine con naldemedina ha indotto miglioramenti significativi e duraturi nella frequenza dei movimenti intestinali, nei sintomi correlati alla stitichezza e nella qualità della vita del paziente 18 (Fig. 3). Durante lo studio non sono stati osservati sintomi da astinenza da oppioidi, né vi è stata la necessità di rimodulare la terapia con oppioidi per inefficacia o ridotta efficacia della terapia stessa, a riprova dell’azione esclusivamente periferica della naldemedina.

Una sotto-analisi degli studi COMPOSE-1 e COMPOSE-2 è andata a valutare l’efficacia della naldemedina nel trattamento della OIC in pazienti che avevano una scarsa risposta ai lassativi 19. Questa analisi post-hoc dei dati integrati dei due studi precedenti ha confrontato l’efficacia della naldemedina in pazienti trattati senza successo con lassativi (poor lassative responder, PLR) con quelli che non hanno ricevuto lassativi > 30 giorni prima dello screening o quelli che hanno ricevuto solo un lassativo di salvataggio durante o dopo lo screening (non-PLR). L’analisi ha incluso 538 (317 PLR, 221 non PLR) e 537 (311 PLR, 226 non PLR) pazienti nei bracci naldemedina e placebo, rispettivamente. C’erano significativamente più responder nei sottogruppi naldemedina PLR (46,4%; p < 0,0001) e non-PLR (54,3%; p = 0,0009) rispetto ai gruppi placebo (30,2 e 38,9%, rispettivamente) 19 (Fig. 4). In entrambi i sottogruppi PLR e non PLR, il trattamento con naldemedina è risultato superiore al placebo per tutti gli endpoint aggiuntivi. L’incidenza complessiva di eventi avversi nei sottogruppi PLR trattati con naldemedina o placebo è stata simile.

Gli studi COMPOSE-4 e COMPOSE-5 sono due trial multicentrici di fase 3 randomizzati in doppio cieco, che hanno valutato l’efficacia e la sicurezza di naldemedina nella OIC in pazienti con dolore neoplastico in trattamento con oppioidi 20. Anche in questo caso la naldemedina è risultata significativamente più efficace rispetto al placebo nel trattamento della OIC (Fig. 5), senza che si verificassero significativi eventi avversi 20.

Una recente sotto-analisi integrata di tre studi di fase 3 (COMPOSE-1, COMPOSE-2 e COMPOSE-3) ha valutato la sicurezza e l’efficacia di naldemedina fino a 12 settimane in un sottogruppo di pazienti di età ≥ 65 anni 21. Un totale del 14,8% (344/2328) dei pazienti aveva un’età ≥ 65 anni in tutti gli studi. L’incidenza di eventi avversi legati al trattamento nei pazienti seguiti con naldemedina di età ≥ 65 anni (45,9%) era paragonabile a quella dei pazienti di età ≥ 65 anni che ricevevano placebo (51,6%) e nel gruppo complessivo con naldemedina (47,1%). Anche l’incidenza di disturbi gastrointestinali nei pazienti di età ≥ 65 anni (20,2%) trattati con naldemedina è stata paragonabile a quella nei pazienti di età ≥ 65 anni che ricevevano placebo (16,1%) e nel gruppo complessivo con naldemedina (21,8%). Questa analisi integrata ha confermato che il trattamento dell’OIC con naldemedina 200 mcg è generalmente ben tollerato ed efficace nei pazienti anziani con dolore cronico non oncologico.
Un’altra sotto-analisi integrata degli studi COMPOSE-1, COMPOSE-2 e COMPOSE-3 ha valutato la sicurezza e l’efficacia di naldemedina nei pazienti con compromissione della funzione renale 22. I sottogruppi erano costituiti da pazienti con funzione normale (velocità di filtrazione glomerulare basale ≥ 90 mL/min/1,73 m2) e compromissione lieve (da ≥ 60 a < 90 mL/min/1,73 m2) e moderata (da ≥ 30 a < 60 mL/min/1,73 m2) della funzione renale. Questa analisi integrata ha confermato che il trattamento con naldemedina è stato generalmente ben tollerato ed efficace nei pazienti con compromissione lieve o moderata della funzione renale. I risultati di sicurezza ed efficacia erano simili a quelli della popolazione complessiva 22.
Due recenti studi di fase 1 hanno valutato la farmacocinetica, sicurezza e tollerabilità di naldemedina in soggetti con compromissione renale di vario grado (lieve, n = 9; moderata, n = 9; grave, n = 6; malattia renale allo stadio terminale, n = 8) e con compromissione epatica (lieve o moderata, n = 8 ciascuna) 23. La valutazione farmacocinetica ha indicato che non sono necessari aggiustamenti della dose di naldemedina per i soggetti con qualsiasi grado di insufficienza renale o per i soggetti con insufficienza epatica lieve o moderata. Naldemedina è stata ben tollerata sia nei soggetti sani che nei soggetti con insufficienza renale o epatica e gli eventi avversi riportati sono stati generalmente coerenti con il profilo di sicurezza noto.
Dal punto di vista soggettivo dei pazienti, una recente analisi ha valutato l’effetto di naldemedina 200 mcg sugli esiti riportati dai pazienti in tre studi clinici di fase 3 (COMPOSE-1, COMPOSE-2 e COMPOSE-3) 24. Gli esiti riportati dai pazienti includevano la valutazione dei sintomi della stipsi da parte del paziente (PAC-SYM), la valutazione della qualità di vita (PAC-QOL) e la soddisfazione globale del soggetto. È stata calcolata la percentuale di pazienti che hanno ottenuto un miglioramento ≥ 1,5 di PAC-SYM e PAC-QOL. La percentuale di responder a PAC-SYM e PAC-QOL è risultata significativamente più elevata per naldemedina rispetto al placebo. La maggior parte dei pazienti trattati con naldemedina ha riportato una soddisfazione marcatamente o moderatamente migliorata per costipazione e sintomi addominali nel questionario per la soddisfazione globale del soggetto.
La rimborsabilità dei PAMORA è normata dalla nota n. 90, che indica i criteri per la corretta indicazione della prescrizione. Secondo la nota n. 90, la prescrizione a carico del SSN dei PAMORA è limitata ai soggetti in terapia cronica con oppiacei e diagnosi di costipazione indotta da oppiacei secondo i criteri di ROMA IV che rispondano contemporaneamente alle seguenti caratteristiche: terapia cronica e continuativa con oppiacei; resistenza al trattamento con almeno due lassativi, di cui uno ad azione osmotica (la resistenza è definita come la mancata risposta dopo 3 giorni).
Bibliografia
1 Camilleri M, Drossman DA, Becker G, et al. Emerging treatments in neurogastroenterology: a multidisciplinary working group consensus statement on opioid-induced constipation. Neurogastroenterol Motil 2014;26:1386-1395. https://doi.org/10.1111/nmo.12417
2 Poulsen JL, Brock C, Olesen AE, et al. Evolving paradigms in the treatment of opioid-induced bowel dysfunction. Therap Adv Gastroenterol 2015;8:360-372. https://doi.org/10.1177/1756283X15589526
3 Kalso E, Edwards JE, Moore AR, et al. Opioids in chronic non-cancer pain: systematic review of efficacy and safety. Pain 2004;112:372-380. https://doi.org/10.1016/j.pain.2004.09.019
4 Andresen V, Banerji V, Hall G, et al. The patient burden of opioid-induced constipation: new insights from a large, multinational survey in five European countries. United European Gastroenterol J 2018;6:1254-1266. https://doi.org/10.1177/2050640618786145
5 Argoff CE. Opioid-induced constipation: a review of health-related quality of life, patient burden, practical clinical considerations, and the impact of peripherally acting μ-opioid receptor antagonists. Clin J Pain 2020;36:716-722. https://doi.org/10.1097/AJP.0000000000000852
6 Fallon MT, Hanks GW. Morphine, constipation and performance status in advanced cancer patients. Palliat Med 1999;13:159-160. https://doi.org/10.1191/026921699677653615
7 Wang DD, Ma TT, Zhu HD, et al. Transdermal fentanyl for cancer pain: trial sequential analysis of 3406 patients from 35 randomized controlled trials. J Cancer Res Ther 2018;14(Suppl):S14-S21. https://doi.org/10.4103/0973-1482.171368
8 Yang Q, Xie DR, Jiang ZM, et al. Efficacy and adverse effects of transdermal fentanyl and sustained-release oral morphine in treating moderate-severe cancer pain in Chinese population: a systematic review and meta-analysis. J Exp Clin Cancer Res 2010;29:67. https://doi.org/10.1186/1756-9966-29-67
9 Huang AR, Mallet L. Prescribing opioids in older age. Maturitas 2017;74:123-129. https://doi.org/10.1016/j.maturitas.2012.11.002
10 Megale RZ, Deveza LA, Blyth FM, et al. Efficacy and safety of oral and transdermal opioid analgesics for musculoskeletal pain in older adults: a systematic review of randomized, placebo-controlled trials. J Pain 2018;19:475.e1-475.e24
11 Allen C, Zarowitz BJ, O’Shea T, et al. Clinical and functional characteristics of nursing facility residents with opioid-induced constipation. Consult Pharm 2017;32:285-298. https://doi.org/10.4140/TCP.n.2017.285
12 Simren M, Palsson OS, Whitehead WE. Update on Rome IV Criteria for colorectal disorders: implications for clinical practice. Curr Gastroenterol Rep 2017;19:15. https://doi.org/10.1007/s11894-017-0554-0
13 Rekatsina M, Paladini A, Drewes AM, et al. Efficacy and safety of Peripherally Acting μ-Opioid Receptor Antagonist (PAMORAs) for the management of patients with opioid-induced constipation: a systematic review. Cureus 2021;13:e16201. https://doi.org/10.7759/cureus.16201
14 Pergolizzi JV Jr, Christo PJ, LeQuang JA, et al. The use of Peripheral μ-Opioid Receptor Antagonists (PAMORA) in the management of opioid-induced constipation: an update on their efficacy and safety. Drug Des Devel Ther 2020;14:1009-1025. https://doi.org/10.2147/DDDT.S221278
15 Kanemasa T, Koike K, Takase K, et al. Pharmacological Profile of naldemedine, a Peripherally Acting μ-Opioid Receptor Antagonist (PAMORA): comparison with naloxone and naloxegol. J Pharmacol Exp Ther 2020;373:438-444. https://doi.org/10.1124/jpet.119.264515
16 Blair HA. Naldemedine: a review in opioid-induced constipation. Drugs 2019;79:1241-1247. https://doi.org/10.1007/s40265-019-01160-7
17 Hale M, Wild J, Reddy J, et al. Naldemedine versus placebo for opioid-induced constipation (COMPOSE-1 and COMPOSE-2): two multicentre, phase 3, double-blind, randomised, parallel-group trials. Lancet Gastroenterol Hepatol 2017;2:555-564. https://doi.org/10.1016/S2468-1253(17)30105-X
18 Webster LR, Nalamachu S, Morlion B, et al. Long-term use of naldemedine in the treatment of opioid-induced constipation in patients with chronic noncancer pain: a randomized, double-blind, placebo-controlled phase 3 study. Pain 2018;159:987-994. https://doi.org/10.1097/j.pain.0000000000001174
19 Hale ME, Wild JE, Yamada T, et al. Naldemedine is effective in the treatment of opioid-induced constipation in patients with chronic non-cancer pain who had a poor response to laxatives. Therap Adv Gastroenterol 2021;14:17562848211032320. https://doi.org/10.1177/17562848211032320
20 Katakami N, Harada T, Murata T, et al. Randomized phase III and extension studies of naldemedine in patients with opioid-induced constipation and cancer. J Clin Oncol 2017;35:3859-3866. https://doi.org/10.1200/JCO.2017.73.0853
21 Wild J, Webster L, Yamada T, et al. Safety and efficacy of naldemedine for the treatment of opioid-induced constipation in patients with chronic non-cancer pain receiving opioid therapy: a subgroup analysis of patients ≥ 65 years of age. Drugs Aging 2020;37:271-279. https://doi.org/10.1007/s40266-020-00753-2
22 Webster LR, Hale ME, Yamada T, et al. A renal impairment subgroup analysis of the safety and efficacy of naldemedine for the treatment of opioid-induced constipation in patients with chronic non-cancer pain receiving opioid therapy. J Pain Res 2020;13:605-612. https://doi.org/10.2147/JPR.S237833
23 Fukumura K, Yamada T, Yokota T, et al. The influence of renal or hepatic impairment on the pharmacokinetics, safety, and tolerability of naldemedine. Clin Pharmacol Drug Dev 2020;9:162-174. https://doi.org/10.1002/cpdd.690
24 Camilleri M, Hale M, Morlion B, et al. Naldemedine improves patient-reported outcomes of opioid-induced constipation in patients with chronic non-cancer pain in the COMPOSE Phase 3 studies. J Pain Res 2021;14:2179-2189. https://doi.org/10.2147/JPR.S282738
Nutraceutica e anziano
Anna Picca
Fondazione Policlinico Universitario “Agostino Gemelli”, IRCCS, Roma
Nell’ultimo ventennio vi è stata un’esplosione di studi che trattano l’uso dei nutraceutici nei soggetti anziani. La complessità dei fenomeni legati all’invecchiamento rende difficile trovare un nutraceutico che possa tenere conto di questa complessità. Negli ultimi anni la strategia della medicina geriatrica è stata quella della compressione della morbidità, che presuppone che ritardando l’età di insorgenza delle malattie croniche e della disabilità, si possa limitare la morbidità a un periodo più breve e più vicino alla fine naturale della vita, riducendo così la quantità totale di malattie e disabilità sostenute. Più di recente, diversi scienziati che si occupano di biologia dell’invecchiamento hanno promosso il concetto di healthspan, inteso come il periodo di vita libero dalle principali malattie cliniche croniche e disabilità 1. Il concetto principale è che la vita può essere suddivisa approssimativamente in due fasi: un periodo di invecchiamento relativamente sano (healthspan) e un periodo caratterizzato da malattie e disabilità associate all’età. Sebbene i recenti progressi della medicina abbiano portato a un aumento della durata media della vita (lifespan), si pensa che ciò sia principalmente il risultato di una maggiore sopravvivenza piuttosto che dall’aumento della vita salute (healthspan) 1 (Fig. 1). È giunto quindi il momento non solo di considerare diverse opzioni terapeutiche per il trattamento delle comorbidità legate all’età, ma di avviare studi clinici con l’obiettivo finale di aumentare la durata della vita in salute (e forse la longevità).

Ad oggi i due interventi capaci di promuovere l’invecchiamento in salute e la longevità sono la dieta e l’esercizio fisico. L’esercizio fisico ha numerosi effetti benefici anti-invecchiamento a livello metabolico 2, poiché aumenta la riparazione cellulare, riduce lo stress ossidativo e l’infiammazione (Fig. 2). Dal punto di vista nutrizionale invece, si ritiene che la restrizionecalorica, insieme alla modulazione nutrizionale del microbiota possano promuovere la salute e la longevità 3.

Poiché non sempre questi interventi sono possibili, avere a disposizione una integrazione alimentare che ci possa consentire di raggiungere le stesse vie metaboliche coinvolte negli interventi sugli stili di vita (dieta ed esercizio fisico) può essere molto importante. In effetti, sono stati identificati dei “superfood” che non solo conferiscono all’individuo un apporto nutrizionale importante, ma anche benefici in termini di salute 1. La ricerca sui nutraceutici ha appunto l’obiettivo di scoprire i composti bioattivi presenti in questi cibi in maniera da poterli integrare non solo nella dieta, ma anche in preparati integratori, che possano portare benefici in termini di longevità.
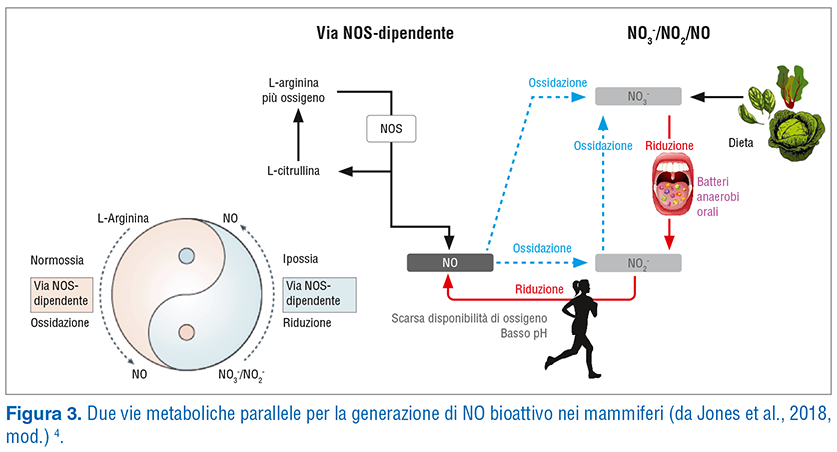
Uno degli interventi è quello che consente di integrare la produzione di ossido nitrico attraverso la supplementazione dietetica di nitrati 4, che si è dimostrata in grado di migliorare la performance fisica in quanto modula la respirazione mitocondriale, riduce il costo di ossigeno dell’esercizio e migliora la perfusione muscolare e cerebrale. L’aumento dei livelli di ossido nitrico può essere ottenuto anche con una supplementazione di arginina, che è un precursore dell’ossido nitrico stesso (Fig. 3).
Durante la pandemia da COVID-19 è stata avanzata l’ipotesi che i cibi contenenti flavonoidi o altri composti fitochimici contenenti fenoli o zolfo possano avere attività antivirali e altre attività benefiche per la salute come un’azione immunostimolante o antinfiammatoria, che potrebbe svolgere un ruolo nel contribuire in una certa misura a prevenire o alleviare l’infezione virale 5. È stato dimostrato che tra i pazienti anziani che sono guariti dal COVID-19, oltre l’80% ha riportato la persistenza di almeno un sintomo, in particolare affaticamento, dispnea, dolori articolari e tosse 6. In uno studio pilota sui pazienti con sintomi persistenti dopo infezione da COVID-19, dati preliminari hanno mostrato che la concentrazione di alcuni mediatori infiammatori era ridotta in seguito all’assunzione per 2 settimane di succo di barbabietola, ricco di nitrati; al contrario, i soggetti trattati con placebo non mostravano modificazioni dei livelli di citochine rispetto a livello basale (Fig. 4). Sarà necessario confermare queste osservazioni in un campione più ampio. Vi era, inoltre, una correlazione tra i livelli di alcune citochine e i test di performance fisica in questi soggetti. È, però, interessante notare che il core di citochine modificate in questi soggetti con sintomi persistenti dopo infezione da COVID-19, relativamente giovani, era abbastanza simile a quello identificato anche in studi su pazienti anziani con sarcopenia.

In molte zone del mondo vengono introdotte nella dieta sostanze naturali (cacao, antocianine, curcuma, ecc.) ad azione antiossidante, che sono oggetto di studio. In uno studio su una popolazione anziana (Studio InCHIANTI) è stata dimostrata una correlazione tra un’aumentata escrezione urinaria di polifenoli e una riduzione del rischio di fragilità 7 e di mortalità 8. Uno studio più recente sulla stessa popolazione ha dimostrato che alcune varianti geniche sono associate a una migliore performance fisica in soggetti ultra-ottantenni, ma in misura minore rispetto a quanto dimostrato negli studi precedenti sui polifenoli 9: ciò suggerisce che la componente ambientale abbia un ruolo maggiore rispetto a quella genetica nell’influenzare la velocità del declino fisico collegato all’età.
Una delle frontiere attuali della ricerca sull’invecchiamento è data dai farmaci senolitici 10, cioè quelli che sono in grado di indurre selettivamente l’apoptosi nelle cellule senescenti 10, ovvero quelle cellule che dopo un certo numero di divisioni cellulari smettono di dividersi a causa dell’accorciamento di telomeri e acquisiscono il cosiddetto “fenotipo secretorio associato alla senescenza” (senescence-associated secretory phenotype, SASP) (Fig. 5); in questo modo tali cellule potrebbero favorire sia le malattie degenerative che quelle neoplastiche 11. Si tratta di un campo di grande interesse e vi sono studi su composti naturali, come la fisetina 12 o la quercetina 13, in grado di esercitare un effetto senolitico.

Sono stati identificati composti di origine naturale, derivati della soia (isoflavoni), che sono in grado di legarsi ai recettori degli estrogeni e possono essere utilizzati nel trattamento dei sintomi vasomotori legati alla menopausa 14. In pazienti che non possono essere sottoposti a una stimolazione dei recettori estrogenici, è stato proposto l’uso di un estratto purificato di polline, trattato in modo che permetta l’eliminazione della componente esterna come possibile allergene 15: i suoi effetti, sui sintomi vasomotori, ma più in generale sulla qualità della vita, sono stati confermati in uno studio condotto in doppio cieco su donne in menopausa 16. Inoltre, il fatto che esso, oltre a un effetto simil-SSRI, possa avere un effetto positivo sul metabolismo proteico ed energetico muscolare 17, ci fa guardare a questo estratto di polline con interesse anche per il suo possibile effetto sulla funzione fisica nell’anziano. Ci sono studi in corso per confermare la possibile utilità in questo senso anche nell’uomo.
Bibliografia
1 Seals DR, Justice JN, LaRocca TJ. Physiological geroscience: targeting function to increase healthspan and achieve optimal longevity. J Physiol 2016;594:2001-2024. https://doi.org/10.1113/jphysiol.2014.282665
2 Fiuza-Luces C, Garatachea N, Berger NA, et al. Exercise is the real polypill. Physiology (Bethesda) 2013;28:330-358. https://doi.org/10.1152/physiol.00019.2013
3 Fontana L, Partridge L. Promoting health and longevity through diet: from model organisms to humans. Cell 2015;161:106-118. https://doi.org/10.1016/j.cell.2015.02.020
4 Jones AM, Thompson C, Wylie LJ, et al. Dietary nitrate and physical performance. Annu Rev Nutr 2018;38:303-328. https://doi.org/10.1146/annurev-nutr-082117-051622
5 Ghidoli M, Colombo F, Sangiorgio S, et al. Food containing bioactive flavonoids and other phenolic or sulfur phytochemicals with antiviral effect: can we design a promising diet against COVID-19? Front Nutr 2021;8:661331. https://doi.org/10.3389/fnut.2021.661331
6 Tosato M, Carfì A, Martis I, et al.; Gemelli against COVID-19 Post-Acute Care Team. Prevalence and predictors of persistence of COVID-19 symptoms in older adults: a single-center study. J Am Med Dir Assoc 2021;22:1840-1844. https://doi.org/10.1016/j.jamda.2021.07.003
7 Urpi-Sarda M, Andres-Lacueva C, Rabassa M, et al. The relationship between urinary total polyphenols and the frailty phenotype in a community-dwelling older population: the InCHIANTI study. J Gerontol A Biol Sci Med Sci 2015;70:1141-1147. https://doi.org/10.1093/gerona/glv026
8 Zamora-Ros R, Rabassa M, Cherubini A, et al. High concentrations of a urinary biomarker of polyphenol intake are associated with decreased mortality in older adults. J Nutr 2013;143:1445-1450. https://doi.org/10.3945/jn.113.177121
9 Heckerman D, Traynor BJ, Picca A, et al. Genetic variants associated with physical performance and anthropometry in old age: a genome-wide association study in the ilSIRENTE cohort. Sci Rep 2017;7:15879. https://doi.org/10.1038/s41598-017-13475-0
10 Kirkland JL, Tchkonia T, Zhu Y, et al. The clinical potential of senolytic drugs. J Am Geriatr Soc 2017;65:2297-2301. https://doi.org/10.1111/jgs.14969
11 Campisi J, Andersen JK, Kapahi P, et al. Cellular senescence: a link between cancer and age-related degenerative disease? Semin Cancer Biol 2011;21:354-359. https://doi.org/10.1016/j.semcancer.2011.09.001
12 Maher P. Preventing and treating neurological disorders with the flavonol fisetin. Brain Plast 2021;6:155-166. https://doi.org/10.3233/BPL-200104
13 Justice JN, Nambiar AM, Tchkonia T, et al. Senolytics in idiopathic pulmonary fibrosis: Results from a first-in-human, open-label, pilot study. EBioMedicine 2019;40:554-563. https://doi.org/10.1016/j.ebiom.2018.12.052
14 Chen LR, Chen KH. Utilization of Isoflavones in soybeans for women with menopausal syndrome: an overview. Int J Mol Sci 2021;22:3212. https://doi.org/10.3390/ijms22063212
15 Münstedt K, Männle H. Apitherapy for menopausal problems. Arch Gynecol Obstet 2020;302:1495-1502. https://doi.org/10.1007/s00404-020-05692-2
16 Winther K, Rein E, Hedman C. Femal, a herbal remedy made from pollen extracts, reduces hot flushes and improves quality of life in menopausal women: a randomized, placebo-controlled, parallel study. Climacteric 2005;8:162-170. https://doi.org/10.1080/13697130500117987
17 Salles J, Cardinault N, Patrac V, et al. Bee pollen improves muscle protein and energy metabolism in malnourished old rats through interfering with the Mtor signaling pathway and mitochondrial activity. Nutrients 2014;6:5500-5516. https://doi.org/10.3390/nu6125500





































